单细胞转录组学揭示了Shp2在myc驱动的肝肿瘤细胞和微环境中的相反作用
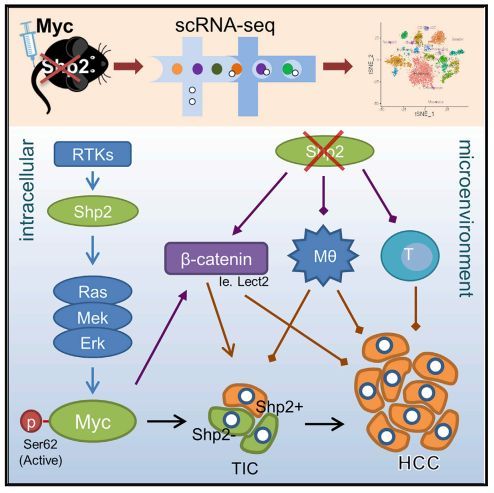
myc驱动的肝脏肿瘤发生机制尚不清楚。该研究表明,在肝细胞特异性Ptpn11/ Shp2缺失的小鼠中,Mycdriven肝癌(HCC)显著加重。然而,在Shp2缺失的肝脏中,Myc诱导的肿瘤选择性地从罕见的Shp2阳性肝细胞中发展,Myc驱动的肿瘤发生依赖于由Shp2促进的完整Ras-Erk信号传导来维持Myc的稳定性。尽管对Shp2细胞自主生长有严格的要求,但Shp2的缺失会导致免疫抑制环境,导致肿瘤起始细胞的清除缺陷和肿瘤的侵袭性进展。

图片来源:https://doi.org/10.1016/j.celrep.2021.1099
基础Wnt/b-catenin信号通路在shp2缺失的肝脏中上调,Myc转染进一步增强了这一信号通路。消融Ctnnb1抑制myc诱导的shp2缺陷肝细胞癌,揭示了b-catenin的重要作用。Myc过表达和CTNNB1突变在预后不良的HCC患者中经常同时检测到。这些数据阐明了肝脏肿瘤发生的复杂机制,其驱动因素是细胞固有的致癌信号,以及通过干扰特定的致癌途径产生的促肿瘤微环境。

图片来源:https://doi.org/10.1016/j.celrep.2021.1099
原发性肝癌是一种高致死率的疾病,在世界范围内发病率和死亡率均呈上升趋势。肝脏肿瘤的发生是由一系列的增殖、代谢和结构改变引起的慢性肝脏疾病。HCC的特点是化疗耐药,通常在晚期诊断,治疗选择有限。尽管治疗效果不佳,但多激酶抑制剂索拉非尼十年来一直是治疗晚期HCC的一线药物。
美国食品和药物管理局(FDA)最近才批准atezolizumab和bevacizumab的联合治疗,在不可切除的HCC中,其总体生存率和肿瘤无进展生存率明显优于索拉非尼。未来开发更有效的基于机制的治疗方法需要更深入地了解肝脏中相互交织的细胞内在和细胞外致瘤信号。
Shp2/Ptpn11是一种含有sh2的酪氨酸磷酸酶,作用于受体酪氨酸激酶(RTKs)和细胞因子受体的下游。遗传和生化分析显示,Shp2在介导rtk激活Ras/Erk通路中发挥了积极作用。虽然其促进Erk信号转导的生物学意义尚不完全清楚,但Shp2确实是第一个被发现的致癌酪氨酸磷酸酶,在白血病和实体肿瘤中检测到Ptpn11的显性活性突变。
药物抑制Shp2可以有效抑制由rtk引发的致癌信号驱动的癌细胞的增殖。在肝细胞中删除Shp2可以抑制HGF受体MET与其他肿瘤蛋白联合驱动的肝肿瘤发生。然而,Shp2缺乏也加重了化学致癌物二乙亚硝胺(DEN)诱导的HCC,并加速了pten缺陷肝脏中非酒精性脂肪性肝炎(NASH)驱动的肝脏肿瘤发生。总的来说,这些研究揭示了Shp2在肝脏中自相矛盾的抗肿瘤和促肿瘤作用,其潜在机制尚不清楚。
c-Myc (Myc)的异常表达与所有人类癌症的50%有关,也与动物模型中各种实验性诱导肿瘤有关。特别是Myc过表达在预后不良的侵袭性肝癌和肝母细胞瘤中。然而,在转基因小鼠中,Myc单独驱动HCC发展效率低下,但需要另一种致癌基因的共同表达或同时删除一种抑癌基因。基因组分析显示,在肝癌患者和小鼠HCC模型中,Myc扩增和CTNNB1/ b-catenin突变经常同时发生。b-Catenin与Myc启动子结合并驱动Myc表达。
通过上位分析,Myc 明显位于肠道中 APC/b-catenin 的下游,但 Myc 缺失并不能抑制肝脏中 APC 丢失的影响,尽管去除 b-catenin 确实有效。Wnt/b-catenin信号通路控制的肝脏氨代谢酶的分区也发现与Myc无关。因此,Myc和b-catenin在肝脏特异性环境下协同致瘤作用的机制尚不完全清楚。

单细胞转录组学揭示了Shp2在myc驱动的肝肿瘤细胞和微环境中的相反作用
图片来源:https://doi.org/10.1016/j.celrep.2021.109974
本研究结合单细胞rna测序(scRNA-seq)与功能和分子分析,揭示了Shp2在肝脏肿瘤发生中的双向功能的复杂机制。值得注意的是,作者发现在Myc驱动的HCC中,通过保持Myc上游完整的Ras/Erk通路,Shp2是细胞自主需要的。同时,Shp2缺失也在肝脏中诱导了促进肿瘤的微环境。
综上所述,这些结果阐明了一种新的肿瘤细胞内在和外在因素交织驱动最严重的肿瘤表型的嵌合机制。本研究阐明了之前记录的Shp2酪氨酸磷酸酶在癌症中的相互矛盾的作用,这将有助于设计更有效的恶性疾病治疗方法。
来源:生物谷

 微信公众号
微信公众号 京公网安备11010502033649
京公网安备11010502033649