国家动物模型信息平台收录TNFRSF4敲除和人源化小鼠模型
目前免疫检查点阻滞剂在肿瘤免疫治疗中受到关注,靶向程序性细胞死亡蛋白1(programmed cell death,PDCD1)和细胞毒T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated protein 4,CTLA4)治疗剂的成功为癌症治疗提供了更多的选择。然而,尽管此疗法在一些患者中能够消除肿瘤并实现患者的长期生存,但并非对所有患者都有效果,许多患者对基于免疫检查点阻断的单一药物治疗有抗药性。因此,具有不同作用机制或不同靶点的新型免疫调节药物亟待开发。
肿瘤坏死因子受体超家族成员4(tumor necrosis factor receptor superfamily member 4,TNFRSF4)(也称为OX40或CD134)是TNF受体超家族的一员,在活化的T细胞上高度表达,有一个已知配体TNFSF4(也称为OX40L或CD252),主要在活化的抗原呈递细胞上表达。TNFRSF4与配体结合并激活后,T细胞中的下游细胞内信号通路激活,导致核因子κB(nuclear factor-kappa B,NF-κB)的转录激活。
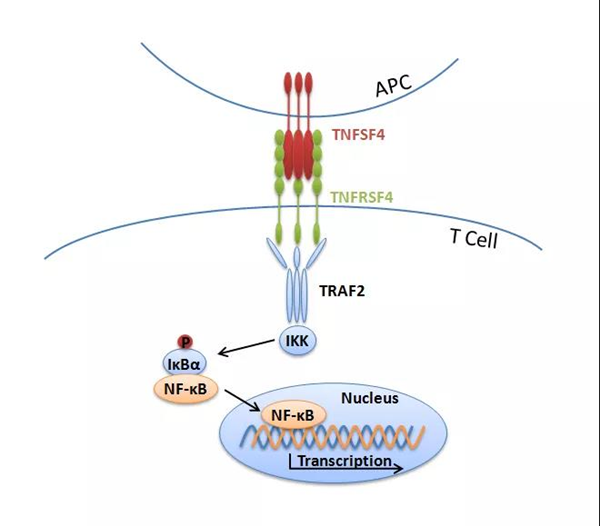
目前,在早期癌症临床试验中测试了几种anti-TNFRSF4激动性单克隆抗体,并且有越来越多的临床前实验支持anti-TNFRSF4激动性单克隆抗体的临床研发。人类和小鼠的TNFRSF4只具有69.17%的同源性,为进一步研究TNFRSF4相关药物,使用TNFRSF4人源化小鼠是更好的选择。
采用CRISPR/Cas9的方法将人源TNFRSF4基因导入到小鼠的受精卵中,同时敲除小鼠内源TNFRSF4基因的表达。TNFRSF4人源化小鼠(TNFRSF4h/h)及TNFRSF4敲除小鼠(TNFRSF4-/-)表型正常。通过建立基因结构和调节方式与人类相似的模型,改善TNFRSF4在人与小鼠中种属差异导致的在临床测试与动物实验结果差异,从而使药物评价的结果更加客观。文章发表在《中国实验动物学报》上。

按照实验方案(图1)。将转录后的sgRNA和Cas9 mRNA混合后通过显微注射技术注射到将C57小鼠受精卵中,移植到ICR假孕鼠子宫内,生出2批小鼠,使用PCR进行基因型鉴定。根据PCR结果,选取分子量不同于野生型条带的PCR产物测序并与野生型小鼠TNFRSF4基因序列比较。结果显示,第1批小鼠中,2#,7#小鼠发生基因敲入,第2批小鼠中,7#小鼠发生基因敲除。将F0代小鼠与C57小鼠进行杂交,获得杂合子TNFRSF4h/m或TNFRSF4+/-,将杂合子互交并将子代进行基因型鉴定(图2),得到纯合敲入或敲除小鼠TNFRSF4h/h或TNFRSF4-/-。
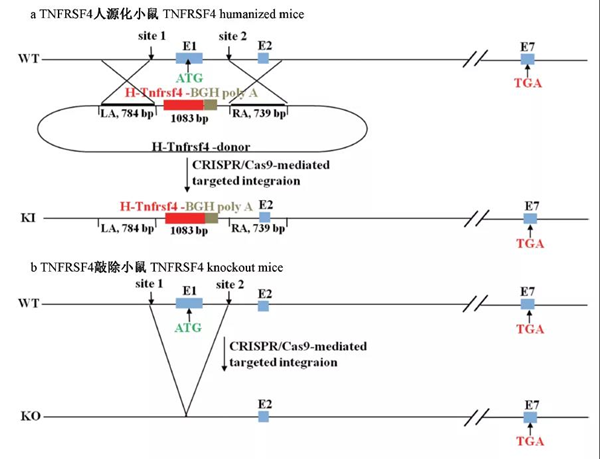
图1 TNFRSF4人源化及敲除小鼠建立方案
注:在sgRNA和Cas9mRNA的参与下,小鼠TNFRSF4第一外显子被剪切。a:使用人TNFRSF4的CDS区及BGH Poly A组成的1083 bp阅读框,成功替换了小鼠TNFRSF4第一外显子的编码区,建立TNFRSF4人源化小鼠。b:阅读框未能替换小鼠TNFRSF4第一外显子的编码区,建立TNFRSF4敲除小鼠。
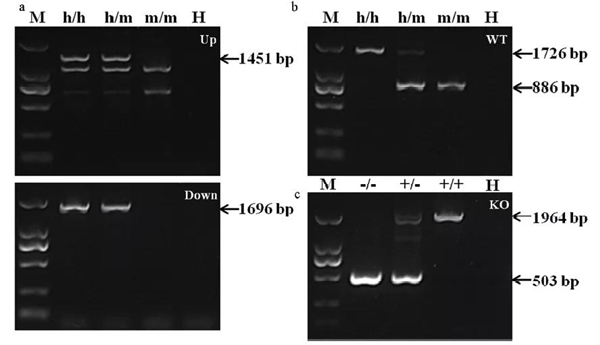
图2 PCR鉴定子代小鼠基因型
注:使用PCR鉴定子代小鼠基因型,突变可传代。M:Marker(TaKaRa,DL2000);H: 水。h/h:TNFRSF4人源化纯合子小鼠;h/m:TNFRSF4人源化杂合子小鼠;m/m:同窝野生型小鼠。a:鉴定使用引物M-TNFRSF4-UP,M-TNFRSF4-DOWN。b:鉴定使用引物M-TNFRSF4-WT。c:-/-:TNFRSF4基因敲除纯合子小鼠;+/-:TNFRSF4基因敲除杂合子小鼠;+/+:野生型小鼠。使用鉴定引物M-TNFRSF4-KO。
为了鉴定小鼠是否在蛋白水平发生TNFRSF4敲除或人源化转入,对TNFRSF4-/-和TNFRSF4-+/+小鼠外周血进行流式细胞鉴定,并使用RT-PCR鉴定TNFRSF4h/h和TNFRSF4m/m小鼠各组织中mRNA表达(图3)。结果显示,在TNFRSF4-/-小鼠的外周血中,TNFRSF4表达被敲除,在TNFRSF4h/h小鼠中,鼠源TNFRSF4被人源替代。
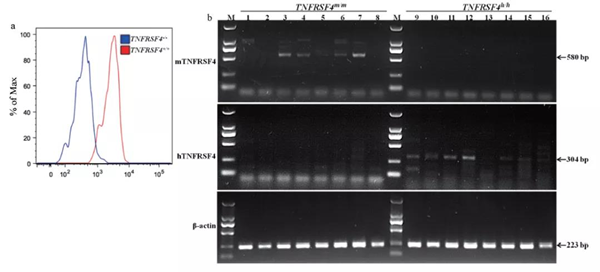
图3 TNFRSF4-/-及TNFRSF4h/h小鼠中TNFRSF4表达
注:a:流式细胞术统计TNFRSF4+/+和TNFRSF4-/-小鼠培养的脾细胞中CD3+CD4+T细胞中TNFRSF4+细胞的直方图。b:TNFRSF4在TNFRSF4m/m(1-8)和TNFRSF4h/h小鼠(9 ~ 16)心(1,9)、肝(2,10)、脾(3,11)、肺(4,12)、肾(5,13)、胸腺(6,14)、脑(7,15)、骨髓(8,16)中的表达。mTNFRSF4:人特异性TNFRSF4引物;mTNFRSF4:小鼠特异性TNFRSF4引物。β-actin:小鼠特异性β-actin引物。M:Marker(TaKaRa,DL2000)。
HE染色结果显示,在TNFRSF4-/-小鼠及TNFRSF4h/h小鼠的各组织中,没有观察到淋巴细胞的浸润(图4),且全身病理检查未发现异常。根据我们的观察结果表明,TNFRSF4h/h 及TNFRSF4-/-小鼠发育正常,在6个月内没有观察到自身免疫性疾病发展的迹象。利用流式细胞术检测了TNFRSF4h/h小鼠外周血中各类细胞的比例,发现其外周血中B细胞(B220+)、T细胞(CD3+、CD4+、CD8+)、粒细胞(CD11b+)和NK(NK1.1+)细胞的比例都没有明显差异(图5)。结果说明人源化TNFRSF4基因后没有改变正常生理状态下小鼠免疫系统的组成。因此,在TNFRSF4h/h小鼠中,人源TNFRSF4等位基因可以替代小鼠TNFRSF4基因。
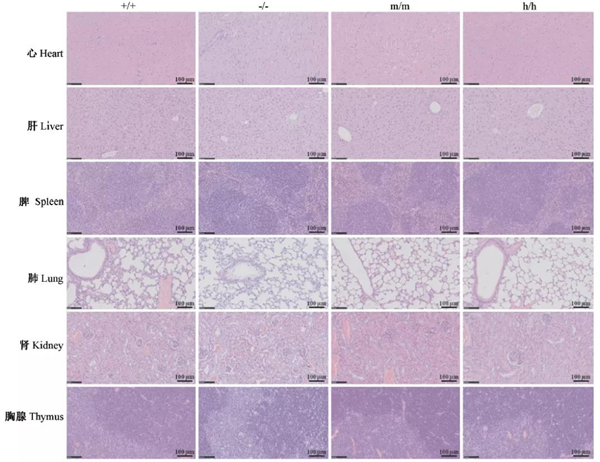
图4 组织HE染色
注:m/m:野生型小鼠;h/h:TNFRSF4人源化纯合子小鼠;+/+:野生型小鼠;-/-:TNFRSF4基因敲除纯合子小鼠。
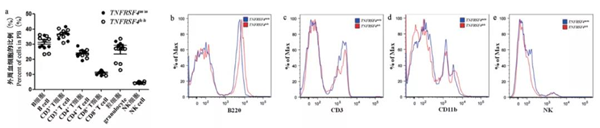
图5 在TNFRSF4h/h小鼠外周血中不同免疫细胞的比例
注:a:流式细胞术统计不同免疫细胞在外周血中的比例。b ~ e:流式细胞术检测外周血中B220(b),CD3(c),CD11b(d),NK1.1(e)表达。
综上所述,利用CRISPR/Cas9技术,建立TNFRSF4基因人源化和敲除小鼠模型,在TNFRSF4人源化小鼠中稳定表达人源TNFRSF4,未检测到小鼠TNFRSF4表达。在TNFRSF4敲除小鼠中未检测到TNFRSF4表达。TNFRSF4人源化及敲除小鼠出生后6个月内均正常存活,组织病理学表型及免疫系统未见明显异常。该模型可用于筛选及评估与TNFRSF4基因相关的治疗性抗体及药物或研究TNFRSF4在免疫过程中作用机制。
目前,TNFRSF4敲除和人源化小鼠模型模型信息已提交到国家动物模型资源共享信息平台(简称信息平台)。信息平台致力于实验动物资源与疾病动物模型信息的收集和共享,希望通过我们的努力,通过信息的集成与共享,更好的服务于国家重大科技攻关,助力于生物医药产业的发展。
欢迎广大科研工作者通过信息平台进行咨询及订购。我们欢迎致力于实验动物领域研究的各位专家在我们的平台分享您的研究成果,也欢迎各位专家在我们平台开展动物模型相关技术的讨论和研究!
参考文献:
黄艺滢, 白琳,雷雪裴, 李珂雅, 李欣悦, 侯丽雅, 石桂英. 肿瘤坏死因子受体超家族成员 4(TNFRSF4)敲除和人源化小鼠模型的建立[J]. 中国实验动物学报, 2021, 29(2):137~144.
扫描关注,了解更多疾病动物模型信息。


 微信公众号
微信公众号 京公网安备11010502033649
京公网安备11010502033649